学术资源
NEJM:lncRNA基因CHASERR缺失引起严重神经发育障碍

2024年10月23日,美国麻省理工学院和哈佛大学的Broad研究所等单位研究人员在NEJM杂志发表了题为“Neurodevelopmental Disorder Caused by Deletion of CHASERR, a lncRNA Gene”的研究论文,报道了三例因CHASERR(一个lncRNA基因)缺失引起严重神经发育障碍的临床病例,并对其发病机制进行了探讨。该研究发现,患儿CHD2蛋白质过量表达与lncRNA基因CHASERR的单拷贝缺失有关。值得注意的是,这是首次发现人类神经系统发育障碍与lncRNA基因缺失有关。
背景
神经发育障碍(Neurodevelopmental Disorder,NDD)是一类在儿童早期表现的复杂疾病,通常有一系列典型的临床表型,如颅面畸形、认知和运动功能障碍、癫痫脑病及脑结构异常等。然而,目前对此类疾病的发病机制了解仍远远不足。CHD2(chromodomain helicase DNA-binding protein 2)基因编码染色质重塑酶,其功能缺失(Loss of function, LoF)与多种神经发育障碍相关。CHASERR是一种高度保守的长链非编码RNA(long read non-coding RNA, lncRNA)编码基因,位于CHD2基因上游。CHD2基因的功能缺失型变异已被证实与早发性癫痫脑病相关,然而CHD2蛋白过表达此前尚未发现与人类疾病相关,CHD2基因上游CHASERR的功能也鲜有研究。
已有小鼠模型研究显示,CHASERR基因通过顺式调控作用负向调控Chd2的表达,对于小鼠的正常发育和存活至关重要:纯合Chaserr敲除小鼠早期致死,杂合敲除小鼠则发生严重发育障碍。本研究旨在揭示CHASERR在人类神经发育障碍中的作用,并深入探索其与CHD2的相互作用机制。为此,研究人员提出以下关键问题:
①CHD2过表达是否也在人类中致病?
②CHASERR基因的变异是否与人类神经发育障碍有关?
③若确实有关,机制为何?具体如何影响CHD2的表达及功能?
研究方法与结果
样本采集与临床评估
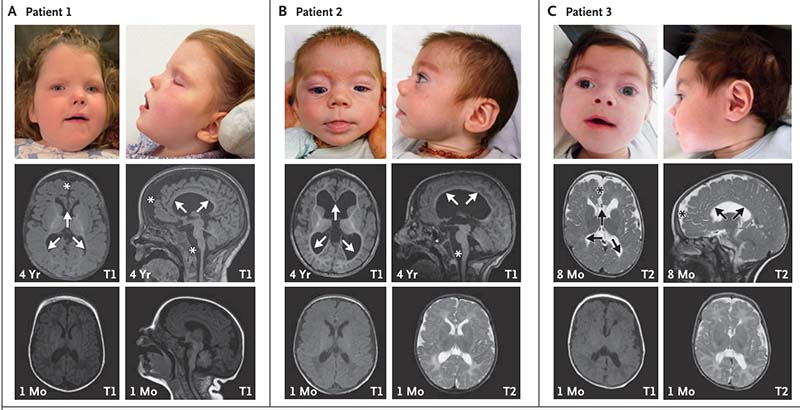
研究团队从3名表现出严重神经发育迟缓的、无亲缘关系的患儿中均检出了CHASERR杂合de novo缺失。这三名儿童均有典型的表型特征,包括严重脑皮层萎缩、脑白质低髓鞘化、颅面畸形、智力与运动能力发育迟缓等。值得指出的是,该研究中其中两例病例通过Matchmaker Exchange (https://www.ga4gh.org/driver_project/matchmaker-exchange/)机制发现并开展了国际合作。
在临床评估中,所有患儿均表现出严重的脑皮层萎缩、脑白质低髓鞘化以及颅面畸形,脑部结构异常:患者的脑部MRI显示显著的脑皮层萎缩,尤其是额叶区域萎缩最为突出;脑白质低髓鞘化现象明显,伴随胼胝体变薄以及视神经萎缩。EEG记录显示所有患者在2岁后均出现广泛的背景活动减慢现象。患者在语言与运动功能上表现出极端受限,至4岁时仍无法独立行走或进行语言交流。相较于CHD2功能缺失,CHASERR缺失综合征患者的神经发育障碍更为严重,过量CHD2表达可能比其功能缺失更具破坏性。
基因组测序
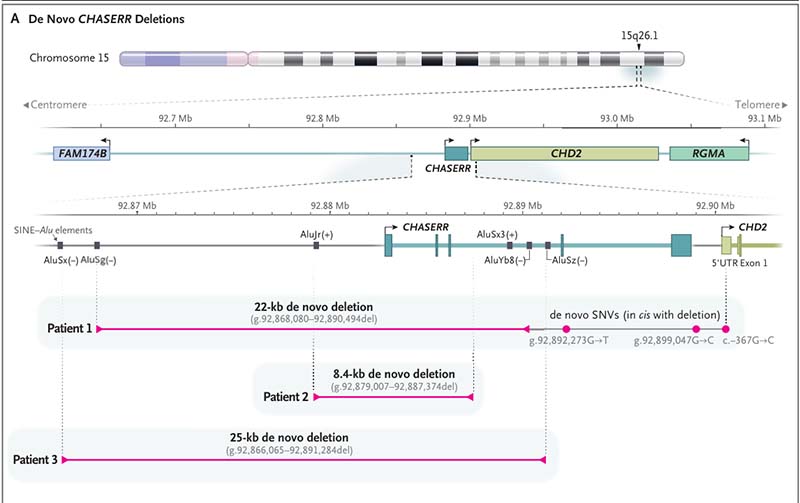
研究团队对患儿及其双亲进行了核心家系全基因组测序(trio-WGS)。结果显示三名患儿的CHASERR基因均存在不同长度的杂合性缺失,这些缺失的长度分别为22kb,8.4kb和25kb,且均未覆盖CHD2的启动子区或编码区。在进一步的长读长测序中,研究人员进一步验证并精确定位了这些缺失的断点,揭示这些缺失通过短串联重复序列(SINE-Alu元件)间的非同源重组生成,并伴随有微小同源性区段(长度为8-40bp)。
RNA表达与蛋白水平分析
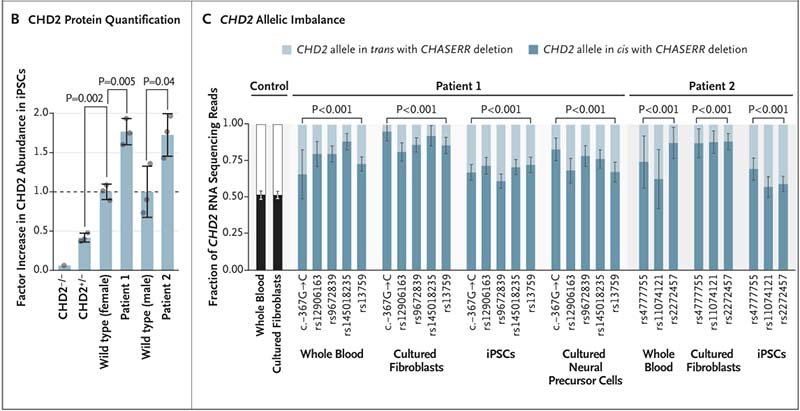
在采集自患儿的外周血样本和体外培养的成纤维细胞中,研究团队对CHD2和CHASERR的转录本丰度进行了分析。结果显示CHASERR缺失导致其下游基因CHD2的表达显著增高,CHD2的转录本丰度在患者样本中远高于健康对照组。
通过诱导多能干细胞(iPSCs)模型中的蛋白质定量检测,进一步分析CHD2蛋白水平,发现患者细胞中CHD2蛋白丰度较正常对照组显著升高(增加1.7-1.8倍)。这种过表达现象与RNA测序的结果一致,从而进一步确认了CHASERR对于CHD2表达的负调控作用。
至此,研究团队基本验证了CHASERR基因缺失引发的顺式调控去抑制导致CHD2过表达。结果显示,CHD2表达显著偏向缺失等位基因的一侧,支持了CHASERR缺失导致CHD2表达去抑制的假设。
lncRNA与CHASERR的作用机制
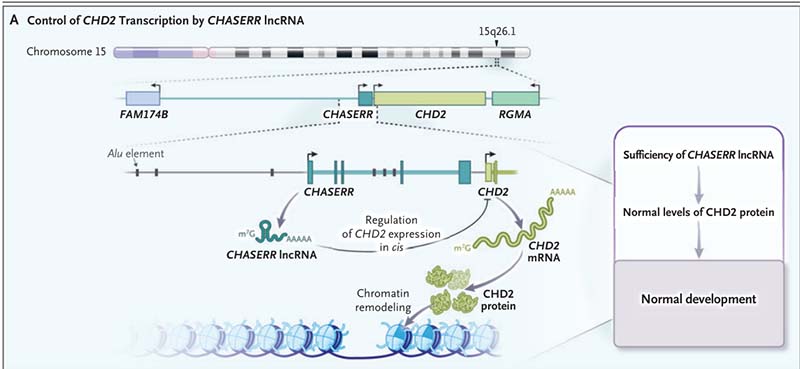
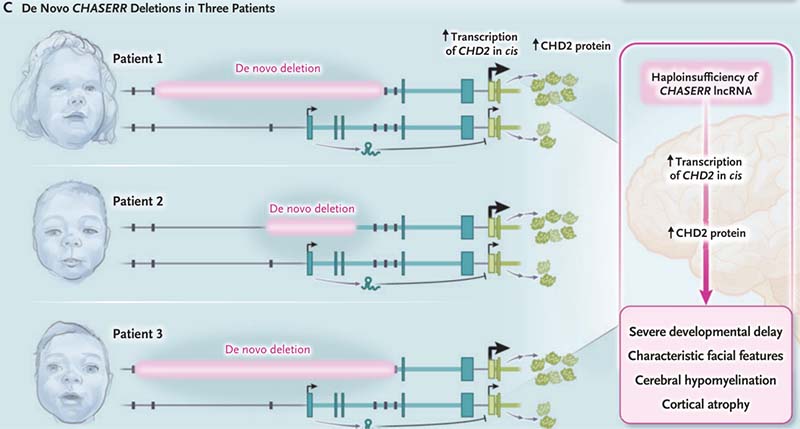
CHASERR作为一段邻近CHD2的lncRNA编码基因,其主要作用通过顺式调控方式实现。研究表明,CHASERR与CHD2共享一个拓扑关联结构域(topological associated domain,TAD),在正常情况下,CHASERR通过与上游增强子的竞争性结合抑制CHD2启动子的活性,从而限制CHD2表达水平。而当CHASERR缺失时,这种负调控作用被解除,导致CHD2的显著过表达。而CHD2作为染色质重塑复合体的重要组分,其功能对于基因组的表达调控至关重要,需要严格的剂量调控。CHD2的过表达会引发染色质的过度开放,进而导致基因表达的广泛失调。在本例中,患儿外周血和成纤维细胞的RNA测序及蛋白质定量分析显示CHASERR缺失导致CHD2表达水平上升了约1.7-1.8倍,且这种过表达效应在iPSC模型中得到了进一步验证,支持CHASERR对CHD2表达负向调控的作用。
结论
通过对三例患儿分析,本研究首次明确了CHASERR基因缺失引发神经发育障碍的机制。虽然CHD2功能缺失变异已被确认与癫痫性脑病相关,但其调控网络中的其他非编码区域如CHASERR此前未被关注。Genash等关注到了小鼠模型研究中所揭示的Chaserr对chd2的负调控作用,并发现其功能对于小鼠生存与发育至关重要;从而由此延申至人类疾病领域,进而发现了人类CHASERR基因在神经发育性疾病中的重要作用:CHASERR通过顺式调控作用负向调节其下游基因CHD2的表达;当CHASERR缺失时,CHD2过量表达,从而引发了一系列神经发育异常。通过WGS和RNA-Seq等方法,Ganesh等人系统性地分析了CHASERR缺失患儿的基因组和转录组,提出了这一缺失通过SINE-Alu元件介导的基因重组形成事件、从而导致CHD2表达异常这一崭新机制。
这一发现强调了lncRNA基因在神经发育及相关疾病中的作用,尤其是lncRNA基因在维持基因表达剂量稳态中的重要性,具有开创性意义。CHD2在剂量调控中具有双向敏感性,因此,CHD2表达水平的精准调控对于维持正常神经功能非常关键。这也提示,未来可以通过干预CHD2的水平实施精准治疗的目的。
NEJM同期配发了由中国科学院分子细胞科学卓越创新中心陈玲玲研究员撰写的“Linking a Neurodevelopmental Disorder with a lncRNA Deletion”科学评述,结合Genash等人的研究工作,系统介绍了lncRNA单倍剂量不足导致神经发育障碍的分子生物学依据。她在文中详细介绍了lncRNA调控基因表达的几种机制以及目前已知的lncRNA与神经系统疾病间的关联。

lncRNA是一类长度大于200个核苷酸且不具备蛋白质编码能力的核糖核酸分子,目前已有大量研究揭示了lncRNA可以不同的分子机制参与基因表达调控,例如:1)顺式调控作用,如CHASERR,通过与邻近基因启动子或增强子的相互作用调控基因表达水平;2)反式调控作用,lncRNA可作为分子支架或诱饵,通过结合蛋白质、microRNA等在基因组的远端位置调控基因表达;3)lncRNA可与DNA链形成R-loop(RNA-DNA hybrid)结构,影响染色质开放状态和基因转录;4)lncRNA还可招募转录因子至靶基因位点调控表达。在Genash等的研究中,CHASERR主要通过顺式调控机制发挥作用,但陈玲玲指出,其他机制在CHASERR-CHD2系统中的作用仍需进一步研究。
她还指出,根据现有数据,约40%的lncRNA在大脑中表达,在神经系统功能中发挥重要作用。先前已经发现一些lncRNA与神经系统疾病相关:BRCA1-AS在阿尔兹海默症患者中表达水平升高、可促进淀粉样β斑块的形成;KCNA2-AS在神经性疼痛患者中表达水平升高,是由于其降低钾通道亚基KCNA2的表达等。此外,在精神分裂症和孤独症中也发现了许多lncRNA的异常表达。而Genash等人的工作首次将lncRNA与神经功能发育障碍联系在一起,具有开创性意义。其一,CHASERR-CHD2的顺式调控机制为研究其他邻近致病基因的lncRNA提供了参考;其二,CHASERR缺失致病提示了基因表达剂量的双向敏感性,在本例中,CHD2过量表达引发了相较于CH2功能缺失更严重的神经发育障碍;其三,这一发现为未确诊的神经发育障碍患者的确诊提供参考,可针对性地对位于已知致病基因附近的lncRNA编码基因进行筛查。
这一成果也表明,未来在对于神经发育障碍患者的诊断中需关注CHASERR及其他可能影响神经元功能的lncRNA。关于潜在的治疗策略,陈玲玲提出可考虑靶向CHD2表达的小干扰RNA(siRNA)或反义寡核苷酸(oligonucleotide)疗法,且剂量的把控需要十分精确。
参考文献
N Engl J Med. 2024 Oct 24;391(16):1511-1518. doi: 10.1056/NEJMoa2400718.
N Engl J Med. 2024 Oct 24;391(16):1542-1545. doi: 10.1056/NEJMe2411291.
