学术资源
对于产前全外未明确病因的结构异常胎儿的重分析:诊断率和产后或尸检表型的贡献

研究背景
约30%-40%的结构异常胎儿经过染色体核型、微阵列芯片(CMA)、及产前全外显子组测序(pES)后仍无法明确病因。
研究目的
评估对未明确病因的pES病例进行系统性重分析的价值,并结合产后及尸检表型数据评估对诊断率的提升作用。
队列设计
纳入法国19家关于发育障碍、畸形综合征、罕见病等遗传中心从2019年6月至2021年11月的150例结构异常胎儿(其中未明确病因的58例结构异常胎儿进行了重分析)的家系全外显子组测序数据。
研究方法
①重新用生物信息学流程分析并注释,生成VCF文件;
②使用“GREP command-line tool”定期查询原始pES数据,以识别文献中最近报道的候选基因的变异;
③对于活产婴儿,收集产后特征包括新生儿检查和1-2岁的随访数据,对于终止妊娠、宫内死亡或新生儿死亡的则收集尸检数据;
④对于更新后的VCF文件中的所有变异进行分析,主要关注ClinVar、HGMD、Decipher等数据库中新报告为P/LP的变异以及最近涉及人类疾病的基因。
研究结果
一、1例重分析后明确病因
· 产前表型:早发且严重宫内生长受限及头围小;
· 2岁表型:小头畸形、斜视、发育迟缓、不会说话、不会走路;
· 重分析结果:SNAPC4基因的一个纯合剪接变异 (NM_003086:c.2527+1G>A);OMIM数据库显示,该基因与常染色体隐性的神经发育障碍伴运动退行,进行性痉挛性截瘫和运动功能障碍(Neurodevelopmental disorder with motor regression, progressive spastic paraplegia, and oromotor dysfunction,NEDRSO)有关,NEDRSO主要临床表型包括发育迟缓、语言障碍或缺失、行走不能、运动功能障碍、智力障碍、脑萎缩、小头畸形、眼部异常(斜视、视网膜缺陷、视力障碍、散光等)、肌肉无力、易疲劳等。
(OMIM,https://omim.org/entry/620515)
· 文献证据:2023年有1篇文献报道在2例宫内生长受限患者中检出,其中1例为一对同胞,且均为纯合;出生后16/18个月出现小头症、发育迟缓(最明显的是运动和语言),同时脑成像显示重度小脑萎缩和轻度脑萎缩。
· 致病性评级:根据ACMG指南,该变异为可能致病性变异(Likely Pathogenic,LP)。
二、2例重分析发现新的VUS
▶Patient 22
· 产前产后表型:孤立的双侧上肢轴后多指畸形;
· 重分析结果:GLI1基因的一个杂合剪接变异(NM_005269:c.535-3A>G),遗传自健康的父亲,spliceAI=0.64,预测影响剪接;OMIM数据库显示,该基因与常染色体隐性遗传的轴后多指(趾)畸形A8型(Polydactyly,postaxial,type A8,PAPA8)和上肢内侧多指(趾)畸形I型(Polydactyly,preaxial I, PPD1)。其中,PAPA8患者主要临床表征包括手和/或脚上存在轴后多指/趾(多出来的手指形状良好且有指甲),部分患者还可能存在身材矮小和膝外翻等。PAPA8的发病率为1-9/100 000。
(OMIM,https://www.omim.org/entry/618123)
PPD1患者主要临床表征包括拇指末节重复和双拇指等,表型严重各不相同。
(OMIM,https://www.omim.org/entry/174400)
· 文献证据:2020年有文献提出GLI1基因致病性变异可能与常染色体显性遗传和不完全外显的后轴多指畸形有关。
· 致病性评级:根据ACMG指南,该变异为临床意义不确定的变异(Variant of Uncertain Significant,VUS)。
▶Patient104
· 产前表型:孤立的双侧内翻足;
· 重分析结果:SYNE1基因的一对复合杂合错义变异(NM_182961:c.20779G>C:p.Glu6927Gln和NM_182961:c.12820C>A:p.His4274Asn);OMIM数据库显示,该基因与常染色体隐性遗传的多发性先天性肌源性关节挛缩3型(myogenic-type arthrogryposis multiplex congenita-3,AMC3)有关,AMC3患者主要临床表征包括产前胎动减少、张力低下、骨骼系统可变缺陷(包括内翻足、脊柱侧凸),以及运动发育迟缓伴行走困难等,部分患者可能存在智力受损。AMC3通常在产前发病,其发病率为<1/1000000。
(OMIM,https://www.omim.org/entry/618484)
· 致病性评级:根据ACMG指南,上述变异为临床意义不确定的变异(Variant of Uncertain Significant,VUS)。
▶Patient18
· 产前表型:NT增厚、法洛四联症、十二指肠梗阻;
· 尸检表型:持续性左上腔静脉、多脾、环形胰腺、肠旋转不良;
· 重分析结果:MMP21基因的一个杂合无义变异(NM_147191:c.1203G>A:p.Trp401Ter);OMIM数据库显示,该基因与常染色体隐性遗传的内脏异位7(Heterotaxy, visceral, 7, autosomal,HTX7)有关,HTX7患者主要临床特征包括先天性心脏畸形(肺动脉闭锁、主动脉弓异常、瓣膜狭窄、室间隔缺损、双侧上腔静脉等)、内脏异位、多脾、肠旋转不良等。
(OMIM,https://www.omim.org/entry/616749)
短读长测序并未发现该基因上的其它具有临床意义的变异;同时,digital droplet RT-PCR排除了该基因双等位基因功能的失活,因此文章排除了该变异。
三、3例重分析后变异降级
根据产后表型对1q21.1 deletion(Patient 4), Xq28 duplication (Patient 139)和CUX1基因杂合无义变异(Patient 14)(NM_001913:c.1671 C > A:p.Tyr557Ter)3个变异进行降级(VUS至LB/B)。
四、5例重分析与pES分析保持一致(VUS)
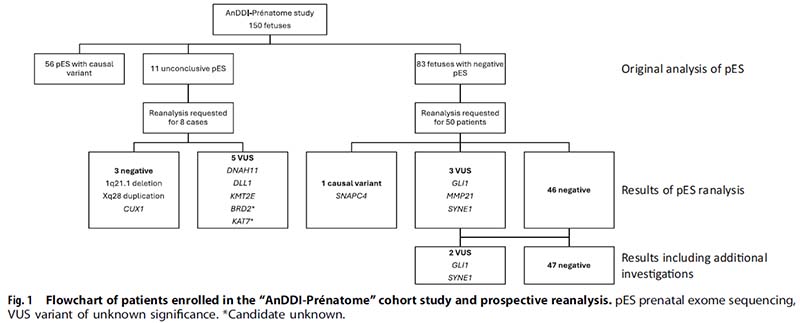
图1.“AnDDI-Prenatome”队列研究及前瞻性重分析流程图。pES:产前全外显子测序;VUS:意义不确定的变异;*候选变异,待进一步确认
讨论
本研究针对pES未明确病因的58例结构异常胎儿进行重分析;重分析间隔时间中位数为30个月,诊断率为1.7%(1/58例);44%的病例在出生时出现新的表型;产后或尸检的表型数据导致产前发现的3个病例的VUS降级,同时新发现2个病例的VUS;
之前的研究报告了10%(95% CI 6.0–13.0%)的诊断率,同时与重分析时间跨度较短相比,当重分析时间超过2年可以获得更高的诊断率(13.0% [95% CI 9.0–18.0%] vs.9.0% [95% CI 6.0–13.0%]);
目前,pES的诊断率仍低于产后ES,据研究表明,针对胎儿结构异常且核型/染色体微阵列(CMA)为阴性的pES的诊断率可达31.0%(95% CI 26.0-36.0%),但对于表型未经删选的病例其诊断率约为15.0% (11.0-18.0%),不同表型诊断率之间差异显著;
与出生后表型相比,产前表型有限,是导致胎儿阴性结果或VUS鉴定的一个因素;
在我们的队列中,出生后/死后表型对pES重分析的价值有限,当仍怀疑遗传原因时,出生后或死后基因组测序可能是一种更合适的方法。
挑战-产前诊断
▶ 产前表型有限;
▶ 胎儿表型是动态变化的;
▶ 胎儿产前表型临床异质性及重叠性低;
▶ 公共的表型-基因型数据库中缺乏胎儿相关的特征;
▶ 遗传自健康父母或有轻微表型父母时,遗传咨询面临挑战;
▶ 额外的功能测定存在限制;
▶ 变异解读在不同实验间存在差异,导致变异分类结果偏差。
