学术资源
多种分子诊断技术联合应用进行单基因遗传病的实验诊断
肝豆状核变性(Wilson disease, WD, MIM 277900)是一种常染色体隐性遗传的铜代谢障碍性疾病,起因于编码铜转运P型ATP酶B(ATP7B)的基因突变,导致铜在肝细胞内转运和经胆汁排泄障碍,过量的铜沉积在肝脏和脑等组织中。WD全球发病率约为1/30000,致病基因携带者约为1/90。人群分布不均衡,在一些近亲结婚人群中发病率明显升高。亚洲人群中的发病率高于欧美人群,东亚地区可高达1/10000。肝豆状核变性临床表现多样,以肝病和神经精神症状为主,少数患者出现内分泌和血液系统症状。
本集向大家介绍1例与WD相关的病例。
● 临床背景
患儿,女,8岁,临床表现为肝脏损害、角膜K-F环及血清铜蓝蛋白下降,临床特征支持肝豆状核变性(WD),其父母及哥哥表型均正常,行ATP7B基因检测来辅助临床诊断。
● 检测分析
首先我们设计肝豆状核变性致病基因ATP7B的引物,运用Sanger测序对受检者及其父母进行ATP7B基因序列测定,但检测结果出乎意料。Sanger测序检测结果只发现受检者一个致病变异,即ATP7B c.2668G>A,且遗传自母亲(图1)。
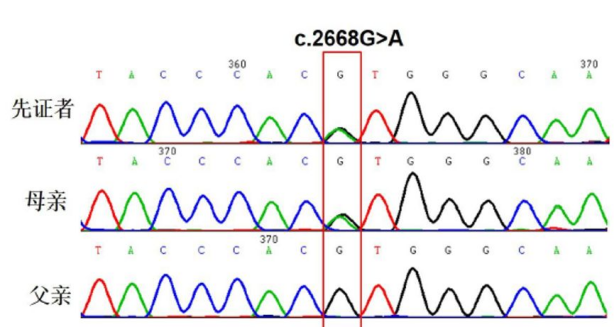
图1 受检者及其父母Sanger测序图
WD是常染色体隐性遗传性疾病,检测结果不符合遗传规律,然而受检者临床表现又很符合WD的诊断,基因检测结果与临床表现不一致。
为什么会出现这种情况呢?
于是,我们再次仔细分析受检者及其父母的ATP7B基因的Sanger测序结果,发现受检者母亲携带5个常见的SNP位点变异,分别为rs1801243G、rs1801244C、rs1061472G、rs732774A及rs1801249C,5个变异均为杂合状态。而其父亲及哥哥也携带这5个变异,所不同的是其中两个变异rs1801243G及rs1801244C为纯合状态。受检者以上5个SNP均为野生型。通过HapMap数据库的查询,发现这5个SNP属于中国北京汉族人群单倍型的标签SNP(图2)。
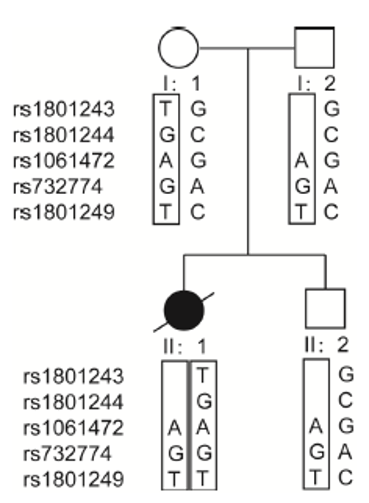
图2 受检者家系ATP7B基因单倍型分析
难道先证者父亲及哥哥的ATP7B基因 rs1801243、rs1801244区域存在微缺失?
带着这个疑问,我们查询了相关文献和数据库。经文献和数据库查询发现,98%的WD由ATP7B双等位基因点突变或小插入/缺失所致,极少数WD是由ATP7B的拷贝数变异(CNV)所致。

数据来源于GeneReviews
接下来,我们运用高分辨染色体芯片分析(CMA)技术对该受检者进行CNV检测,结果显示受检者13q14.3区域存在4kb的杂合缺失,该CNV包含ATP7B 2、3号外显子,正好覆盖rs1801243及rs1801244。该CNV尚未见任何报道,人群数据库DGV中也没有收录。结合该CNV的蛋白功能影响及已有文献报道,我们判断该变异为致病性变异。

图3 受检者ATP7B基因2、3号外显子CGH芯片结果
与此同时,我们又用qPCR技术对结果进行验证(图4),结果表明受检者、受检者父亲及哥哥ATP7B基因2、3号外显子的拷贝数约为正常对照的1/2,提示三人携带该片段的杂合性缺失;受检者母亲结果无异常。
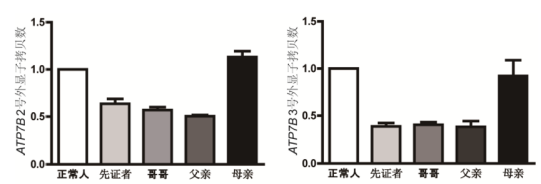
图4 受检者家系 ATP7B基因2、3号外显子qPCR检测结果
● 结论
综上所述,先证者同时携带母源性致病性变异(ATP7B c.2668G>A)和父源性致病性CNV(ATP7B基因2、3号外显子缺失),符合常染色体隐性遗传疾病的遗传模式,故基因检测支持临床诊断。
● 结束语
导致疾病发生的变异有很多,包括点突变、外显子缺失/重复、染色体上大片段的缺失重复、动态突变、融合基因等。了解疾病的致病机制,是疾病检测和遗传数据分析的前提;只有明确疾病的致病机理,在此基础上选择合适的检测方法或者是综合多种检测技术,并在分析时关注合适的变异,才能有效找出导致疾病的遗传病因。
