学术资源
一个被异戊酸血症耽误的小胖威利
临床信息
送检样本:男,五岁
临床表型:异戊酸血症,外院检查曾提示IVD基因存在变异。现母亲备孕,想做产前检测。
检测项目:OmniSeek®全外显子组检测
WES分析结果
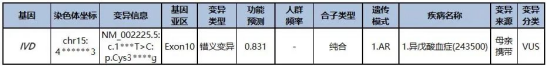
确实检出IVD基因的一个纯合变异c.1***T>C,该变异暂无文献病例报道,经过ACMG评级之后分类为:
临床意义不确定的变异:(PM2_Supporting+PP3_Moderate+PM3_Supporting+PP4)

IVD基因与常染色体隐性遗传的异戊酸血症相关,主要表现为“汗脚臭”气味、喂养困难、呕吐、发育迟缓、高氨血症、代谢性酸中毒、酮症酸中毒、脱水、血小板减少症、白细胞减少症、全血细胞减少症、骨髓增生低下等,检测提示异戊酸血症、异戊酸尿症和异戊酰甘氨酸尿症。50%的病例是急性发病严重的新生儿疾病(通常会导致患儿迅速死亡),50%是慢性发作(无症状间歇期)。
但是经父母样本验证,提示母亲为杂合变异携带者而父亲为野生型。
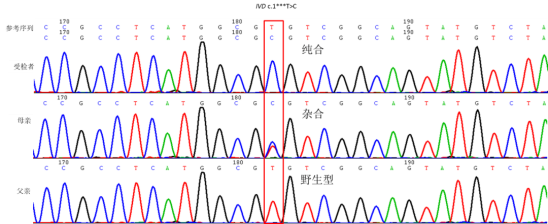
为何出现以上情况?
至少5种可能
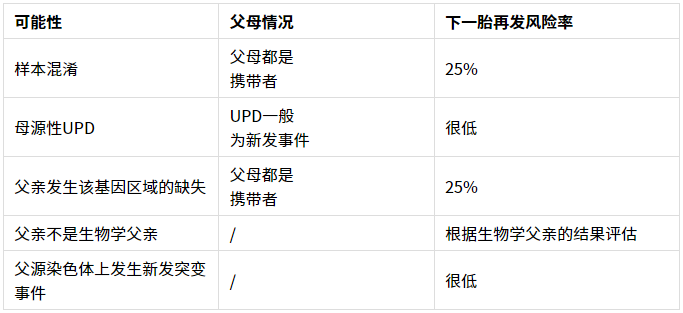
随后在排除样本混淆和父亲该基因区域缺失,以及亲缘关系确认后,我们结合NGS数据的ROH分析结果:提示受检者15q11.2-15q21.3存在ROH,而IVD基因刚好位于这个区域内。
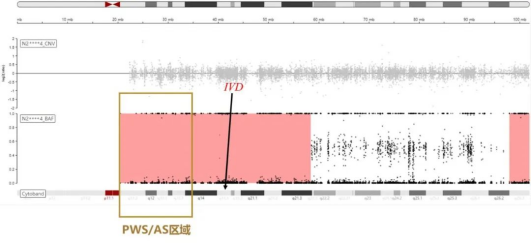
那么,结合SNV检测结果提示母亲为IVD基因变异c.1***T>C杂合子而父亲不携带,且受检样本无其他聚集的ROH,我们推测该ROH区为母源性单亲二体(mUPD)所导致。
但是问题又来了,15q11.2-15q21.3的ROH区域刚好包含了15q11.2-q13印记区域。
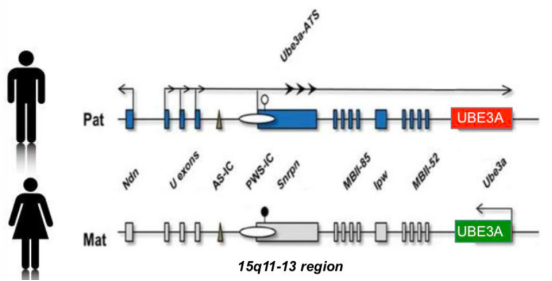
15q11.2-q13母源性UPD会导致小胖威利综合征(Prader-Willi syndrome,PWS)。
PWS的特征包括:婴儿期肌张力不足、喂养困难、生长不良、发育迟缓和身材矮小,从儿童时期开始因食欲增长而导致肥胖。患者还通常有轻度到中度的智力障碍、行为问题(如脾气爆发、固执、强迫行为)、睡眠异常等。

15q11.2-q13父源性UPD可导致天使综合征(Angelman syndrome,AS)。
AS主要影响神经系统,疾病特征包括:发育迟缓、智力障碍、严重的语言障碍以及运动平衡问题(共济失调),大多数受影响的患儿也有复发性癫痫、小头畸形、微笑、大笑、拍手动作、多动、睡眠困难等。
那么,根据我们推测受检者应该是母源性UPD,小胖威利综合征患者
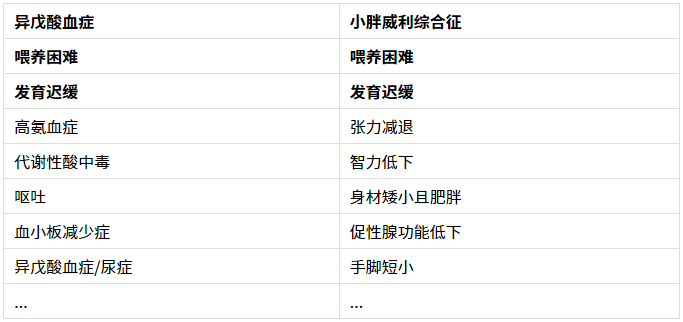
对比一下异戊酸血症和小胖的表型,有交叉...
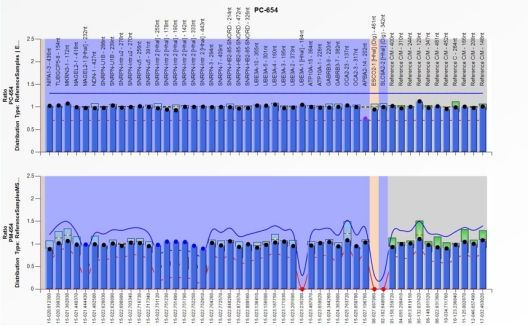
之后患儿送检了PWS-MLPA:
结果提示甲基化水平异常,为母源性单亲二体,PWS确认!

病例总结
▲ 这个病例的实质分子机制是15q11-q21的母源iUPD,导致PWS;
▲ 母亲是IVD基因的杂合突变携带者,但IVD基因碰巧位于15q11-q21区域,当子代发生iUPD时,则导致该变异呈纯合状态。
病例感悟
相较于传统的全外分析,我们看不到ROH,而做CMA又无法分析SNV/indels。通过此次病例,我们发现对全外数据的一个扩展分析(包括家系全外的基因型的分析、BAF图的分析或者是ROH的分析等),或许可以发现以往会被忽略掉的一些内容。例如本次病例,如果没有分析ROH,可能就单纯的报告了IVD基因的变异,而忽视了更为严重的母源iUPD导致的PWS。若该病例做的是家系全外的分析,我们还可以从全外的数据去进一步的去确认ROH的来源,从而或可节省做MLPA检测的费用及时间,还可以让病人的诊断周期大大的缩短。
