学术资源
低比例嵌合,假阳性?看完你就知道了~
受检者信息
男,12岁,确诊癫痫1年
现病史
患儿1年前因“9天内无热抽搐2次”确诊为癫痫,当时临床表现为双眼上翻斜视,神志不清,口角少许流涎,四肢强直抖动,躯体侧倾,抽搐持续半分钟左右停止,1年内患儿口服德巴金片1片一天2次,期间无抽搐再发,患儿出现偶尔发呆现象,每次持续2-3秒。自发病以来,无抽搐时患儿神志清,精神可,胃纳可,大小便无殊,体重无明显改变。
既往史
患儿语言发育落后,8岁时浙江省儿童医院确诊多动症,心理干预及药物治疗2年后好转。否认“肝炎、肺结核”等传染病病史,否认“高血压、糖尿病、脑血管病、肺病、肾病”病史,否认“药物、食物”过敏史,否认输血史,否认外伤及其他手术,否认长期特殊用药史。
个人史
母亲孕期体健,否认放射线及有害物质接触史,系G1 P1 36周+3剖宫产,否认产伤窒息史,圣后母乳喂养,7个月开始添加辅食,现普食;生长发育落后正常同龄儿,3个月会抬头8个月会坐,预防接种按计划进行。
家族史
父母体健,非近亲结婚,无兄弟姐妹,否认父母两系三代中有家族性遗传性疾病及传染病史,否认类似病史。
检测方法
采用金诺JunoXomeTM全外显子组测序(WES)进行基因检测。
检测结果
通过DNA提取、文库构建、测序、数据分析等步骤,最终受检者的检测结果如下所示:

备注:nonsense:无义变异;XLR:X连锁隐性遗传;de novo:新发;P:致病性变异
这个结果什么意思呢?下面跟着小编来了解下吧~
结果解读
检测结果显示,该患儿的ATP7A基因第3502位点上存在C碱基到T碱基的变异(ATP7A c.3502C>T );该变异较为罕见,千人基因组数据库、ExAC数据库、gnomAD数据库、ESP6500数据库、台湾500数据库、cg69数据库及本地数据库均未收录该变异;且该变异为无义变异(nonsense),属于功能缺失性变异(LoF),功能预测软件结果倾向于致病性。
根据文献资料显示,ATP7A基因的致病性变异可导致Menkes病(Menkes Disease,MD),该疾病呈X连锁隐性遗传模式。MD是由ATP7A基因缺陷而导致的体内铜代谢障碍性疾病,该疾病表型多样,其中以进行性神经退行性病变为主要表现,患儿还可表现为头发卷曲,眉眼、睫毛颜色较浅,喂养困难,发育迟缓、智力障碍、癫痫、肌张力高等特征。典型MD于婴儿期发病,少部分可生存至20岁以上。

图1 ATP7A基因信息
在NGS数据分析中,我们发现ATP7A(c.3502C>T)该位点reads呈现嵌合,嵌合比例约为25%,如图2所示。
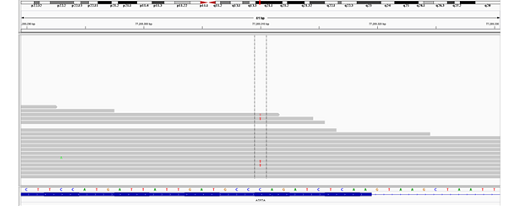
图2 ATP7A基因变异c.3502>T测序结果IGA示意图
Tips:何为嵌合?
嵌合(Mosaicism)指的是源自相同合子的个体细胞中存在两种及以上不同遗传物质的现象,即一个生物体中至少包含两组DNA。人体嵌合体是比较普遍的一种自然现象,只是由于大多数嵌合体患者都只是在进行DNA检查才被发现而已。嵌合体不容易被发现,普通检查DNA不一定能检查到,因为嵌合变异可能存在体细胞中,也可能存在胚细胞中。但通常只有存在体细胞中的嵌合变异才会有表型出现或可通过分子诊断方法检测出来,而存在胚细胞中的嵌合变异通常在遗传给多个子代时才会被发现。
如此低水平嵌合的基因变异,会不会是假阳性?
起初我们也存在上述疑虑,故我们对受检者及其父母进行ATP7A c.3502C>T 的Sanger测序验证。
经Sanger测序验证,该变异属于新发变异,父母均未发生变异。
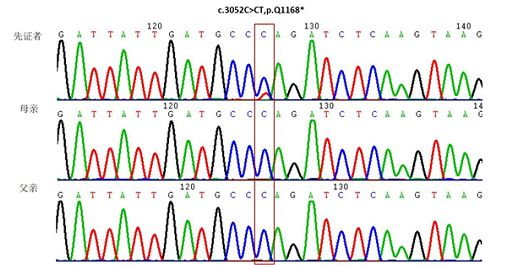
图3 先证者及其父母ATP7A基因变异Sanger测序验证结果示意图
最后经权威数据库和文献检索发现,有病例报道在2名台湾籍MD男性患者中检测到ATP7A基因变异c.3502C>T。HGMD数据库中未收录该变异;ClinVar数据库中存在1条“致病性变异”的记录。
比对受检者表型与MD的临床症状,发现受检者表型与MD部分相符,这可能是不同的嵌合比例影响了受检者的临床表型。
结论
结合上述变异人群频率、遗传模式、文献报道及基因型-表型影响信息,根据美国医学遗传学与基因组学学会(ACMG)指南,该ATP7A c.3502C>T 为 “致病性变异(P)”。可能因该变异的嵌合状态,使得该受检者较典型的Menkes病临床症状较轻,发病时间也较晚。
建议临床医生通过临床检查确认该受检者其他临床表型以做进一步的诊断,并至专科门诊行遗传咨询。
疾病科普
疾病简介
Menkes病是一种罕见的先天性铜代谢异常疾病,主要临床特征表现为毛发呈捻转毛、患珠毛,生长障碍,神经系统退化,同时伴有肌张力低下,癫痫发作,精神运动发育障碍,发育迟缓和智力落后等症状。
典型Menkes病患儿一般在婴儿期开始发病,且通常在3岁之前死亡。在极少数情况下,Menkes病是在儿童时期开始发病。Menkes病发病率约为1:100,000。
发病病因
Menkes病主要是由ATP7A基因突变所导致的。ATP7A基因可为机体提供赖氨酸氧化酶等铜酶,用于调节体内的铜含量。铜是许多细胞功能所必需的,但如果体内铜含量过多,则会引起铜中毒。ATP7A基因突变会导致铜在体内的分布不均,例如肾脏和小肠等部位的铜大量积累,而在大脑和其他组织中的铜含量则非常低。铜供应的减少,也相应的会引起体内铜酶活性的降低,从而导致机体发育和功能障碍,引起Menkes病。
遗传模式
Menkes病呈X连锁隐性遗传模式,一般以男性发病居多,女性大多数为致病基因携带者。如果母亲是致病基因携带者,则儿子有50%的机会患病,而女儿不会患病;如果父亲是Menkes病患者,母亲正常,则儿子不会患病,女儿均为致病基因携带者。其中,大约有1/3的Menkes病病例是由ATP7A新发突变所引起的,无Menkes病家族史。
干预治疗措施
Menkes病的治疗主要依赖铜剂补充和对症治疗、护理。由于Menkes 病患者肠道铜吸收障碍,口服铜剂无效。国外经验证实,组氨酸铜皮下注射是控制Menkes 病的有效办法, 欧美、日本一些早期治疗的患者获得了良好的疗效。目前国内尚无注射用组氨酸铜制剂,主要治疗仍以对症治疗及家庭护理为主。
参考来源:
1、https://ghr.nlm.nih.gov/condition/menkes-syndrome
2、https://www.ncbi.nlm.nih.gov/books/NBK1413/
3、Freed D, Stevens E L, Pevsner J. Somatic mosaicism in the human genome[J]. Genes, 2014, 5(4): 1064-1094.
4、王峤, 丁圆, 王静敏等.3 例Menkes病患儿的临床与ATP7A基因分析及1例产前诊断研究[J]. 中国当代儿科杂志, 2014, 16(6): 624-628.
5、王爽, 李典. Menkes病临床及实验室特点与基因诊断 [J] . 中华实用儿科临床杂志,2016,31( 10 ): 787-791. DOI: 10.3760/cma.j.issn.2095-428X.2016.10.016
