学术资源
Nature Genetics:人类整倍体和非整倍体的单细胞转录组图谱
编者按:在临床诊疗实践中,在反复不明原因流产或胚胎停育/死胎等情况发生时经常发现染色体三体(trisomy)或者单体(monosomy),但对于三体或者单体发生时基因表达或者基因表达调控及其调控在细胞和组织器官发育中发挥何种作用等缺少单细胞水平分辨率的基础数据。这些数据和知识将对我们理解人类生殖细胞的正常发育分化、出生缺陷防控等发挥重要作用。

2024年6月5日,Nature Genetics在线发表了中南大学林戈课题组与华大生命科学研究院商周春课题组合作的研究成果“A single-cell transcriptome atlas of human euploid and aneuploid blastocysts”。文章通过scRNA-seq技术绘制了人类整倍体及非整倍体囊胚的单细胞转录图谱,揭示了染色体倍性对囊胚发育的影响,发现上胚层(EPI)是囊胚发育的调控中心;通过TGF-β和FGF信号传导通路介导各谱系的细胞命运,且TGF-β和FGF信号下降是非整倍体胚胎(尤其是单体)EPI发育异质性及外胚层(TE)成熟不足使得胚胎植入失败的主要原因。
研究背景
染色体非整倍性是人类早期胚胎发育阻滞、流产和出生缺陷的主要原因。减数分裂错误会形成非整倍体胚胎,如三体(染色体重复)及单体(染色体缺失)。有丝分裂错误则会形成嵌合体胚胎。胚胎植入前遗传学检测(Preimplantation genetic testing,PGT)是检测非整倍体的有力工具,利用PGT发现囊胚阶段1-22号染色体上均检测到三体和单体,而流产胚胎中主要检测到常染色体三体和性染色体非整倍性,极少涉及常染色体单体,表明单体胚胎的发育潜能更低,容易发生临床前妊娠丢失。但目前对于人类非整倍体胚胎发育潜能下降的分子机制、三体和单体胚胎表型不同的原因仍不清楚。
研究结果
一、人类非整倍体囊胚中存在4个谱系
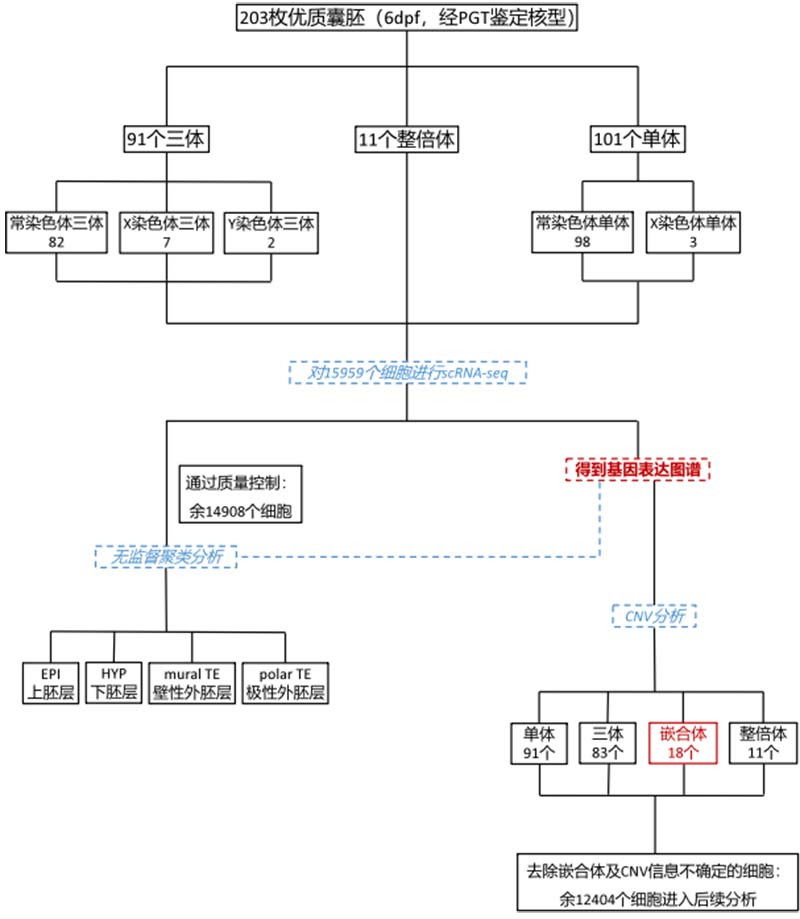
作者首先对203个优质胚胎的15959个细胞进行了scRNA-seq,基于PGT结果,其中包括91个三体、101个单体和11个整倍体,以整倍体胚胎为对照。在14908个细胞中,三体、单体和整倍体细胞在可用片段数、检测到的基因数及RNA的基因组成分方面没有明显差异。无监督聚类鉴定出四个谱系的整倍体和非整倍体囊胚:上胚层(EPI, 胚胎前体)、下胚层(HYP, 卵黄囊前体)和滋养层(TE, 发育为极性滋养层polar TE和壁性滋养层mural TE以介导着床和胎盘形成)。三体、单体和整倍体囊胚均表达EPI、HYP、polar TE和mural TE的谱系特异性标记,其中一些标记在非整倍体和整倍体之间存在差异。这表明虽然在非整倍体中存在基因表达的改变,但染色体获得/丢失对基因表达的影响是有限的。同时在对整倍体和非整倍体囊胚中各谱系的细胞数量评估时发现,与三体和性染色体异常相比,常染色体单体在所有谱系中的数量显著减少,这表明染色体丢失相较于增加对胚胎发育的影响更为严重。
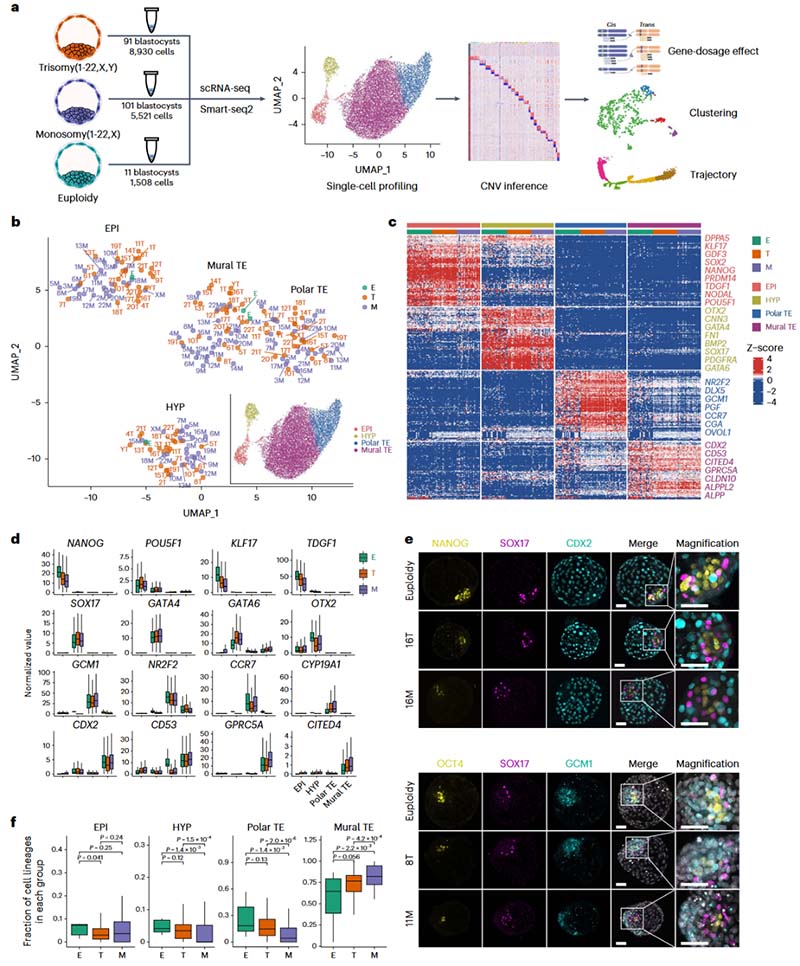
图1.单细胞转录组图谱对人类非整倍体囊胚中存在4个谱系的说明
二、非整倍体通过染色体拷贝数变异引起基因剂量失衡,一些基因存在剂量补偿机制
为验证PGT结果的准确性,作者随后利用单细胞转录组数据开展染色体拷贝数变异(Copy number variation, CNV)分析,发现91%囊胚单细胞核型与PGT一致,说明单细胞转录组推断的CNV信号跟胚胎的PGT核型具有较高一致性。在排除嵌合胚胎和具有未定义CNV信号的非整倍体和整倍体细胞后,12404个单个细胞被纳入后续分析。每个非整倍体和相应的整倍体染色体的转录本丰度显示出RNA水平和CNV之间强相关性;非整倍体胚胎与正常胚胎的差异基因分析显示,特定染色体上19.5±1.2%的基因表现出明显的剂量补偿效应,即在三体胚胎上调,单体胚胎下调,定义这些基因为cis-DEGs。并且cis-DEGs在染色体上并非随机分布,而是在特定的G-bands区域富集。在鉴定出的90个剂量敏感的G-bands中,其中有25个已知与疾病相关。在非整倍体染色体的大部分基因对剂量不敏感,只有25.6%±3.8%的基因表现出剂量补偿,其余基因的剂量效应不显著。
值得注意的是,DNA甲基化作为早期胚胎发育中基因表达的重要调节因子,利用胚胎单细胞DNA甲基化数据集进行的评估显示在cis-DEGs中,8.3%-52.9%的DNA甲基化与染色体CNV呈正相关,表明存在着其他剂量补偿机制。
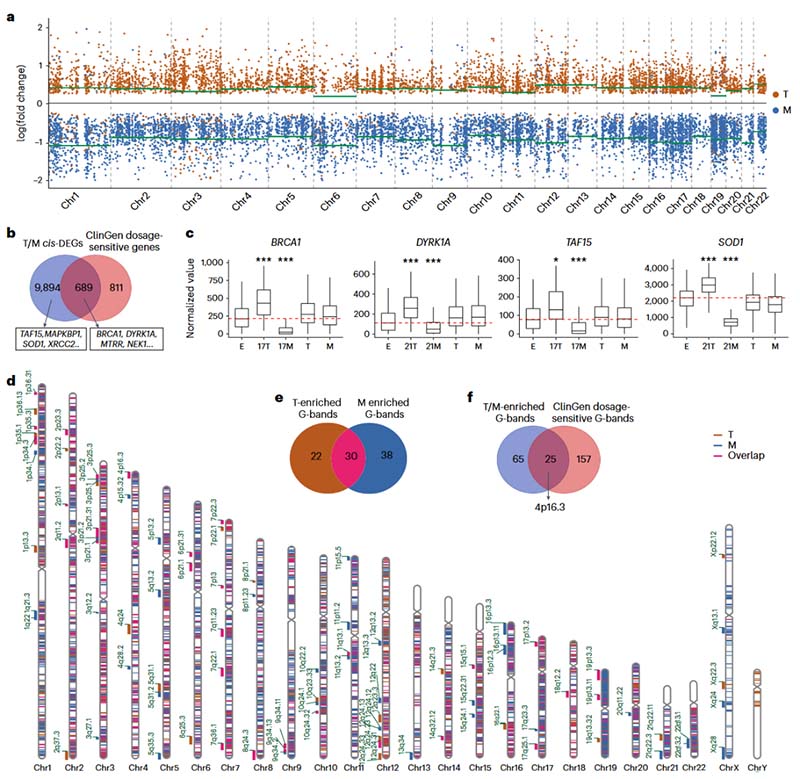
图2.染色体特异性转录组改变对非整倍体的反应
三、转录组相应非整倍体发生全局性变化
首先,非整倍性通过多种途径影响基因表达。染色体数目的变化会影响cis-DEGs,且非整倍体的反式差异基因(trans-DEGs)表达表现出显著下调。大量的trans-DEGs是由非整倍体染色体上编码的转录因子(TFs)所调控的;cis-TFs与trans-DEGs构成了复杂的非整倍体调控网络,约50%–60%的trans-DEGs是cis-TFs的下游靶标,并且在单体中比在三体中更明显。
其次,非整倍体会导致细胞凋亡的增加。多个非整倍体模型都呈现了共同的基因表达特征,基因本体论分析(Gene ontology,GO)显示各种细胞凋亡和应激反应相关的基因在单体中过度表达。同时,由于细胞凋亡指数与囊胚细胞数呈负相关且单体细胞评分高于整倍体细胞,从而说明单体囊胚的细胞数较少。
再次,非整倍体影响胚胎活力。与氨基酸代谢和抗原加工/呈递相关的基因在非整倍体中下调,此类基因表达的不平衡可能引起蛋白周转的负担增加,从而说明非整倍体诱导的转录组变异可能导致非整倍体囊胚(尤其是单体)的各种功能发生显著变化并降低其活力;且结合前文体积胚胎谱系中与非整倍性相关的转录本差异的胚胎谱系标记基因集显示,非整倍体对于EPI有更大的影响,且单体中的偏差显著高于其他非整倍体。
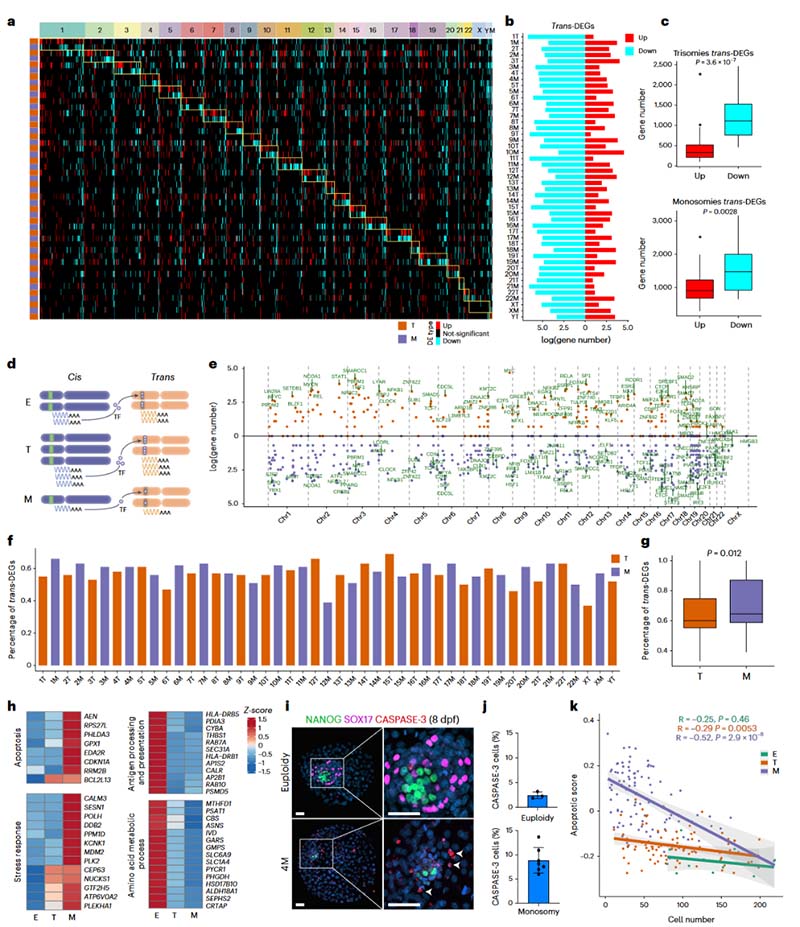
图3.转录组相应非整倍体发生全局性变化
四、非整倍体影响早期胚胎上胚层的发育
数据处理降维算法(Uniform Manifold Approximation and Projection,UMAP)分析显示上胚层群体中存在四个不同的亚群(EPI1-4),其中EPI3存在于整倍体中,而EPI1、EPI2、EPI4主要存在与非整倍体性胚胎中,尤其是单体;这表明非整倍体严重破坏了EPI的正常发育轨迹。通过发育轨迹重建与正常胚胎发育比较,EPI1类似于早期8细胞阶段,EPI3与D6上胚层和幼稚多能干细胞相似,EPI4表现出多能性及滋养层的特征。非整倍体胚胎表现出异常的EPI发育,在特定单体中发现的EPI1表明发育延迟,类似于胚胎的早期阶段;EPI4则显示出向TE过早分化并失去多能性的迹象。多能性标记在非整倍体的EPI3中下调,表明多能性状态受损,可能影响胚胎发育。
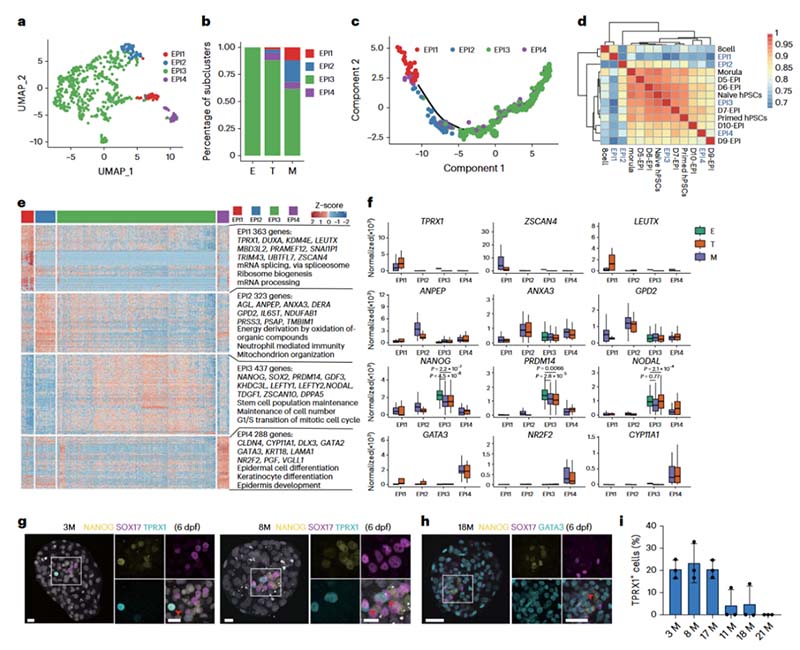
图4.非整倍体的上胚层发育不稳定
五、人类早期胚胎EPI的发育主要受TGF-β和FGF信号通路调控,非整倍体中信号的下调导致发育不稳定及异常的细胞命运决定
配体-受体对分析显示,人类囊胚EPI主要表达TGF-β及FGF信号通路相关配体,且对应的受体在四个谱系中广泛表达。值得注意的是,TGF-β和FGF信号通路相关配体在非整倍体EPI(尤其是单体EPI)中显著下调。为进一步评估TGF-β和FGF信号转导在早期人类胚胎中的作用,通过scRNA-seq分析显示抑制TGF-β和FGF信号会导致多能性标志物NANOG下调,并出现具有早期发育阶段特征的细胞(TPRX1阳性细胞;TPRX1是人类8细胞期胚胎的关键转录因子),形成表现异质性的囊胚EPI;而在单体囊胚体外延长培养体系中补充外源性TGF-β和FGF信号激活因子发现单体胚胎EPI数量显著升高,证明人类早期胚胎EPI的发育进程主要受TGF-β和FGF信号通路调控。
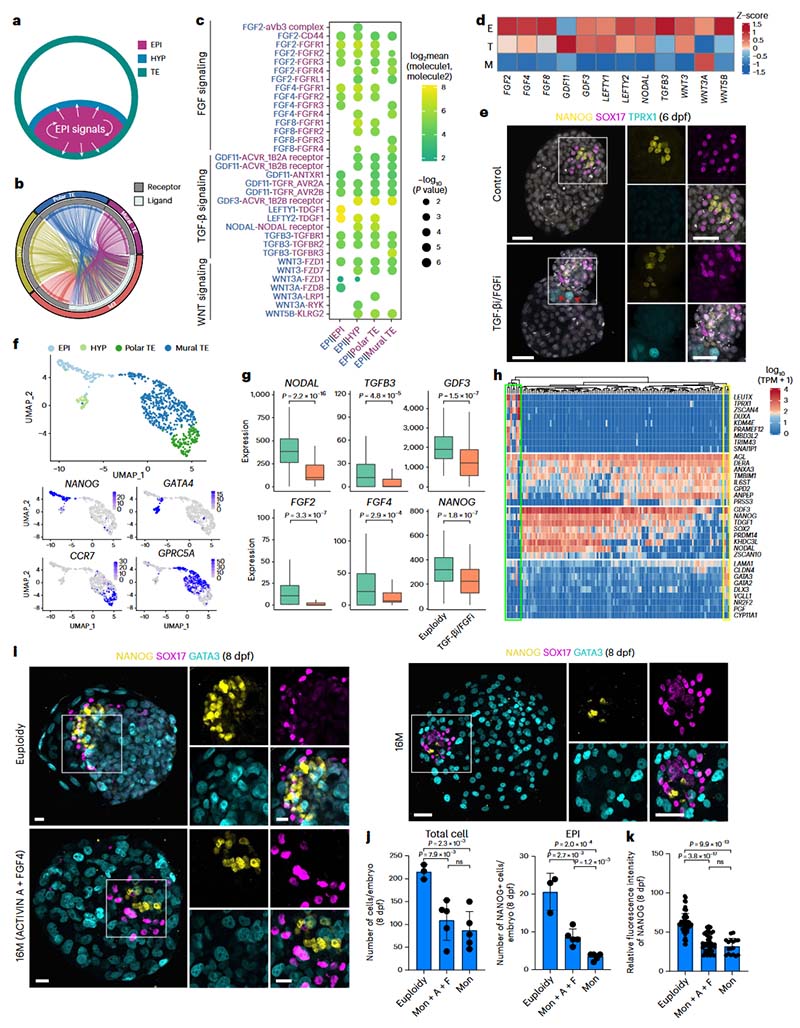
图5.TGF-β和FGF信号在非整倍体的EPI中减弱
六、非整倍体HYP中的细胞应激特征可能归因于基因剂量效应
UMAP分析显示HYP谱系中存在三个不同的亚群:HYP1和HYP3存在于整倍体和非整倍体胚胎中,HYP2在非整倍体胚胎中富集。其中,HYP1表达胆固醇吸收基因,HYP2富含应激反应基因,HYP3表达TE谱系标记,可能位于HYP上皮和TE交叉点的边缘。非整倍体HYP显示出应激迹象,表明非整倍性会影响正常HYP发育。与整倍体胚胎相比,单体胚胎显示出的应激标记HSP70水平较高而HYP标记SOX17水平较低,且单体胚胎中HYP整体形成减少。进一步研究发现,如果抑制TGF-β和FGF信号通路,应激特征基因表达与整倍体并无显著差异,且仍会形成SOX17阳性HYP,但确实会减少SOX17阳性细胞的数量。这表明HYP的发育可能并不严格依赖于TGF-β和FGF信号通路。此外,虽然单体胚胎的HYP和应激标志物减少,但外源补充TGF-β和FGF信号并未显著改善单体胚胎中的HYP形成,这表明观察到的细胞应激反应和HYP减少可能对HYP的发育并不必要。
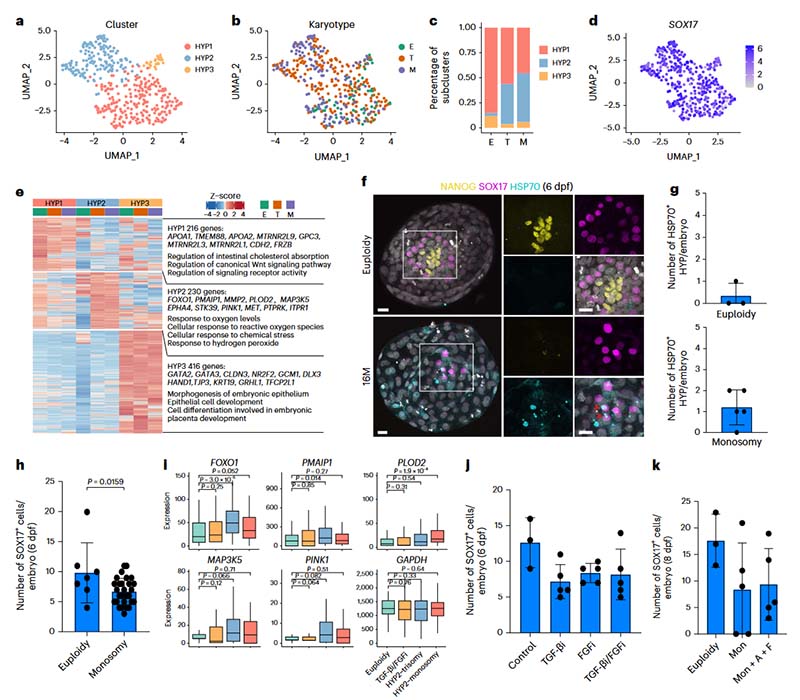
图6.基因剂量失衡导致非整倍体HYP中的细胞应激特征
七、来自非整倍体EPI的TGF-β和FGF信号减弱可能导致非整倍体囊胚的TE成熟不足
拟时序分析表明TE可分为4个不同时期(phase1-4),从壁滋养层端(phase1-2)到极滋养层端(phase3-4)逐渐趋向成熟。基因特征表明phase3-4与囊胚和子宫内膜细胞的相互作用有关。细胞密度分析发现三体和单体胚胎在phase3-4的比例显著低于整倍体胚胎,表明非整倍体(尤其是单体)中的TE成熟不足。在早期人类胚胎中,EPI信号(TGF-β和FGF信号)诱导局部TE成熟并促进与子宫内膜细胞的相互作用。在人类植入前胚胎中抑制TGF-β和FGF信号显示类似单体胚胎TE成熟不足的表型;而向非整倍体胚胎提供此类信号则会增加极性TE的形成。这阐明了EPI可通过旁分泌TGF-β和FGF信号调控TE谱系成熟,并解释了单体胚胎植入失败的可能原因。
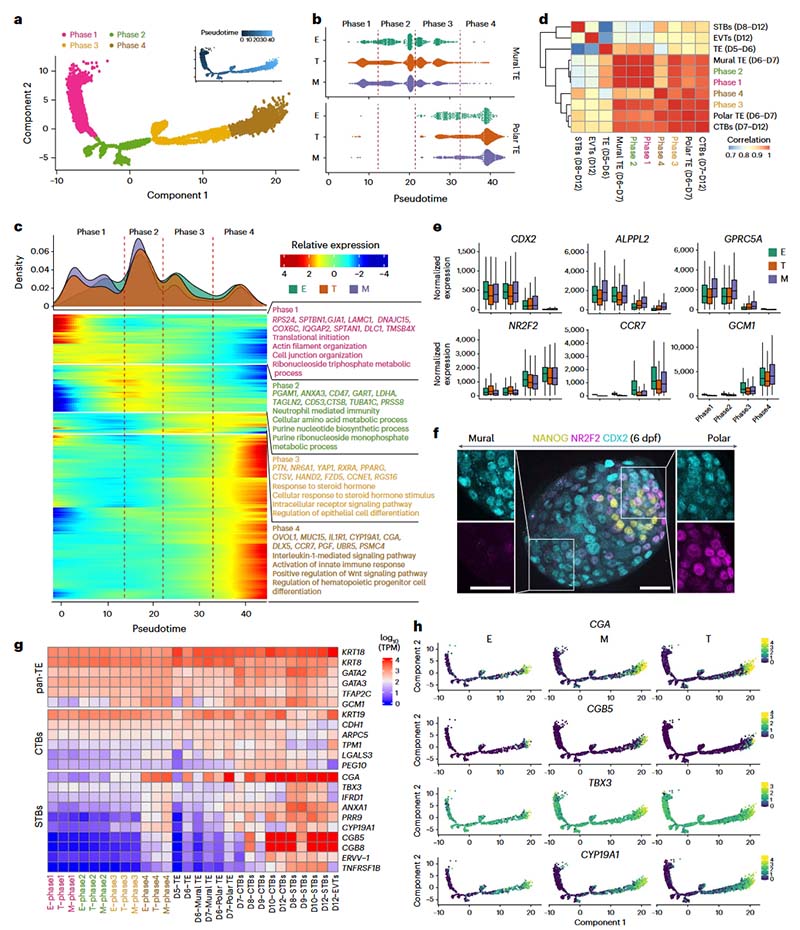
图7.整倍体和非整倍体中囊胚的TE表型
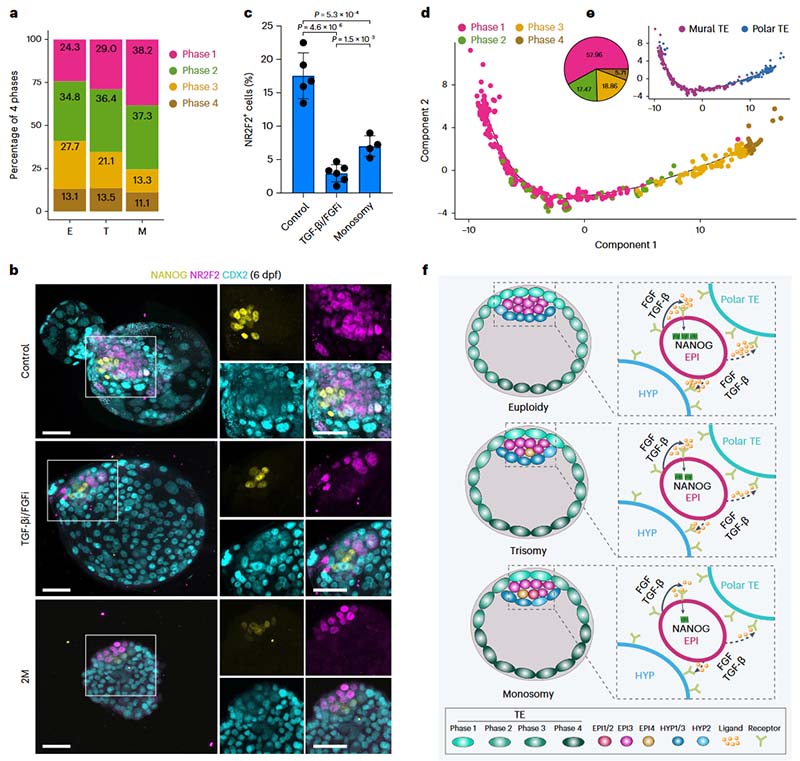
图8.非整倍体中囊胚的TE成熟不足
研究总结
本篇文章主要讨论了非整倍体对人类囊胚发育的影响,着重分析了EPI信号TGF-β和FGF在调节多能性、TE分化及囊胚形成中的作用。作者利用了scRNA-seq的工具用于分析单细胞水平的基因表达,克服了传统批量RNA-seq只能检测样品中所有细胞平均基因表达的缺陷,使得研究人员得以在高分辨率下研究囊胚内细胞群的异质性,更好地了解非整倍体对囊胚内不同细胞谱系的影响。
研究团队首先探索了剂量补偿机制,但其有效性似乎有限;接着在细胞谱系之间进行对比,发现与TE谱系相比,EPI谱系在胚胎早期发育中受到非整倍性的影响更大。接着他们进一步验证了来自EPI的TGF-β和FGF信号传导通路在囊胚发育过程中的枢纽作用,非整倍体引起的EPI信号传导缺陷可导致囊胚发育迟缓,而补充外部TGF-β和FGF配体有望部分恢复在非整倍体胚胎中观察的TE成熟缺陷,可能是一种潜在的治疗方法。总之,研究团队利用scRNA-seq技术绘制单细胞基因表达图谱,并通过信号传导通路解释了非整倍体对早期胚胎发育的影响。
