学术资源
Nature:单等位基因随机表达可控制先天免疫缺陷的表型外显率

2025年1月1日,Nature在线发表了哥伦比亚大学Dusan Bogunovic团队的研究成果 “Monoallelic expression can govern penetrance of inborn errors of immunity”。本研究提出,单等位基因随机表达(autosomal random monoallelic expression, aRMAE)可能是导致先天免疫缺陷(Inborn Errors of Immunity, IEIs)表型差异的关键因素。aRMAE是一种细胞随机选择单个等位基因进行表达的现象,与印迹基因和X染色体失活的机制不同,是一种稳定的转录本命运,而非短暂的基因调控状态。aRMAE可调控细胞中突变基因的表达比例,从而影响疾病的发生与表型。aRMAE与疾病外显率的关联对于揭示单基因疾病的发病机制具有重要意义。
研究背景
先天免疫缺陷(Inborn Errors of Immunity, IEIs)是一组由遗传缺陷引起的单基因疾病,通常有反复感染、自身免疫性疾病或肿瘤高发等临床表现。然而,携带同一致病突变的个体并不总是发病,这种现象被称为“不完全外显(incomplete penetrance)”,这一现象长期以来困扰着遗传学和医学研究。以往的研究尝试从修饰基因、环境因素影响等方面解释这种现象;然而,尽管上述因素在部分病例中得到验证,但它们无法全面解释IEIs外显率差异的机制,尤其是在相同家系中具有相同突变的成员具有不同临床表型的情况。
aRMAE是指细胞随机选择单个等位基因进行表达的现象,这种机制可能在某些基因突变的表型差异中起重要作用。相较于印迹基因或X染色体失活,aRMAE具有随机性(与等位基因的父源或母源来源无关)、稳定性(表达状态可在细胞分裂过程中稳定传递)与异质性的特点。为探究该机制与IEIs疾病外显率之间的关联,研究人员主要关注以下几个问题:
Q1.aRMAE是否广泛存在于IEIs相关基因中?
Q2.表观遗传标记(如组蛋白修饰和DNA甲基化)是否影响aRMAE的形成?
Q3.aRMAE具体如何在携带相同突变的个体间导致不同的临床表型?
A1.aRMAE现象在全基因组范围基因与IEIs基因中均广泛存在
全基因组分析显示,约5.2%的基因具有aRMAE特性。在140个IEI基因中,2.1%偏向参考等位基因,2.8%偏向替代等位基因,显示aRMAE广泛存在于免疫功能相关基因中。具有aRMAE特性的基因分布在所有染色体上,未表现出特定功能或染色体区域的偏向。与基因印迹或X染色体失活的稳定表达不同,aEMAE基因在不同克隆T细胞间的表达不完全一致,即具有表达模式异质性的特征。
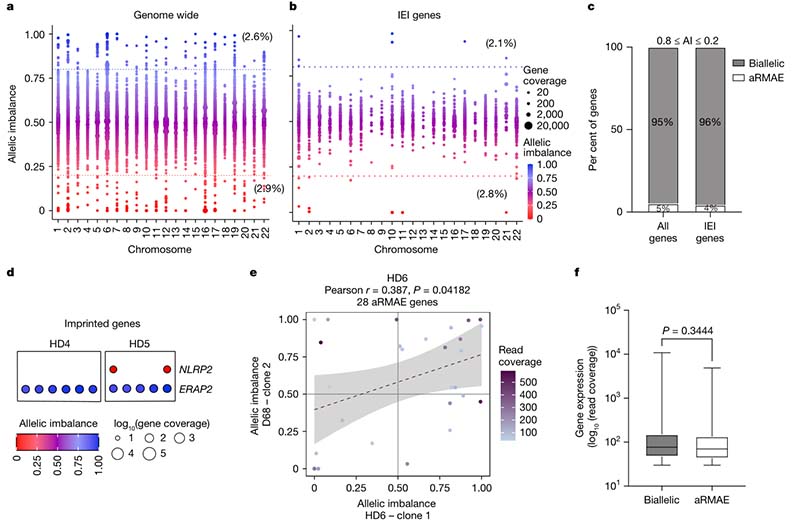
图1.(a-c)aRMAE在全基因组与IEI基因中均存在;(d-f)与印迹基因的表达模式不同,aRMAE具有表达异质性
A2. 表观遗传对于aRMAE的调控作用
分别设计针对JARID1B(组蛋白H3K4me3去甲基酶)、JMJD3(组蛋白H3K27me3去甲基酶)和DNMT1(DNA甲基转移酶)编码基因的siRNA进行干扰实验,结果表明:1)JARID1B干扰:T细胞克隆中的PLCG2等位基因不平衡没有表现出显著变化;2)JMJD3干扰:JMJD3的siRNA干扰导致部分T细胞克隆中PLCG2从aRMAE转变为双等位表达,表明H3K27me3在aRMAE的调控中起重要作用;3)DNMT1干扰:干扰DNA甲基化后,PLCG2在部分克隆中从双等位表达转变为aRMAE。以上siRNA干扰实验表明,表观遗传修饰对于aRMAE的形成确有重要作用;JMJD3(即组蛋白H3K27me3去甲基)可能有利于aRMAE的形成,而DNMT1(即DNA的甲基化)则可能干扰aRMAE的形成。
A3.临床病例验证
①PLCG2基因致病性变异病例
PLCG2编码PLCγ2,这是一种在钙流(calcium flux)以及B细胞NK细胞激活中发挥关键作用的蛋白质。PLCG2中exon 19(PLCG2wt/Δex19)和exon 20-22(PLCG2wt/Δex20-22)的杂合性缺失与PLCG2相关抗体缺陷和免疫失调(PLAID)相关,从而导致冷诱发荨麻疹和不完全渗透抗体缺乏。具体而言,携带PLCG2基因exon 19缺失突变的成员表现出抗体缺陷和钙离子流量的显著下降。
通过RT-PCR检测PLCG2wt和PLCG2ΔEx19等位基因的表达,患病成员(Ⅲ-1)中突变型等位基因的表达占比达90%以上,这一比例直接导致了B细胞功能异常,尤其是Ca2+流量的下降。健康成员则显示双等位表达或偏向野生型等位基因表达的模式,这与其正常的B细胞功能一致。这证明了aRMEA可影响细胞表型(B细胞钙流信号)并进而影响临床疾病表型(低丙种球蛋白血症)。
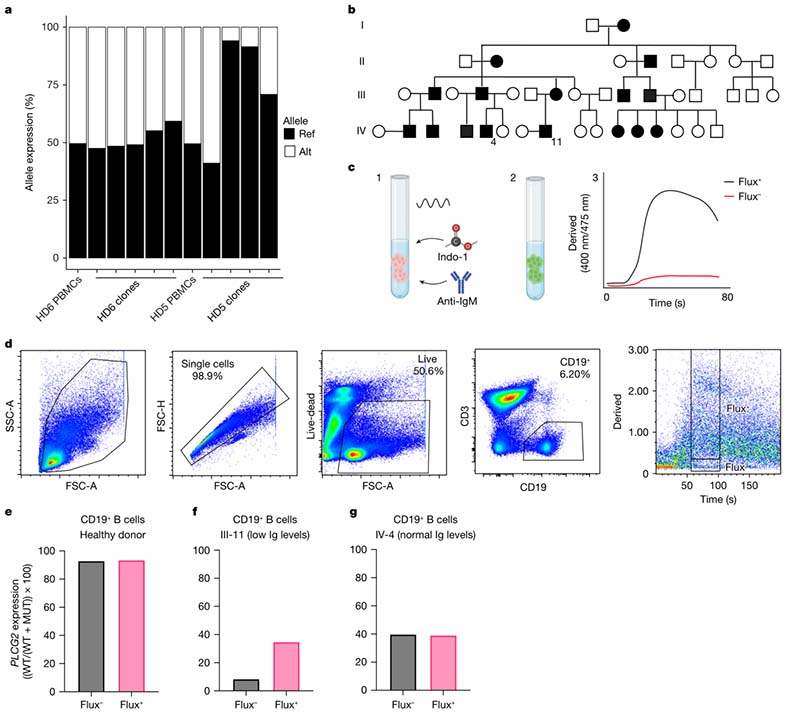
②JAK1基因功能获得性变异病例
JAK1通过JAK-STAT信号通路编码细胞因子信号转导的关键介质,该基因的功能获得性(gain-of-function, GOF)突变会导致JACCD综合征(JAK1 GOF相关自身免疫、过敏、结肠炎和皮炎)。
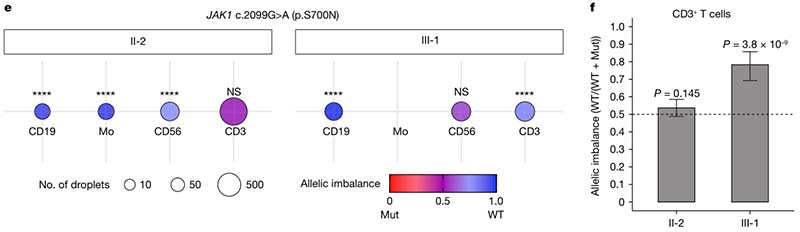
在一个具有JAK1 c.2099G>A(p.S700N)杂合性GOF变异的家族中,共有三名家庭成员有此突变(I-1、II-2 和 III-1),而只有一名(II-2)表现出临床症状。通过使用荧光标记的TaqMan探针和ddPCR技术检测II-2和III-1野生型和突变型JAK1的等位基因表达水平,发现PBMC中III-1表达突变等位基因的比例仅有22%,而II-2表达突变等位基因的比例则达到36%,这提示突变等位基因的表达水平可能与疾病外显率有关。
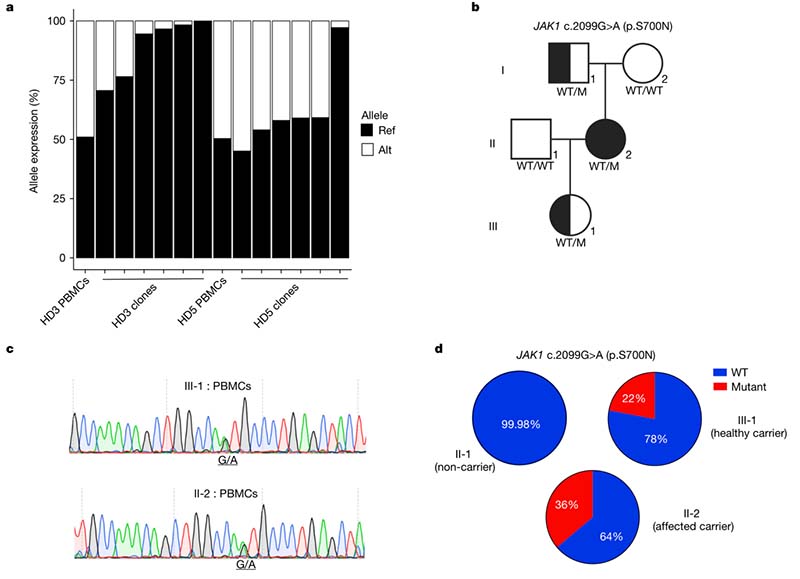
通过对杂合子III-1 和 II-2 的分选细胞的评估发现,健康个体的T细胞表达野生型JAK1比例更高,而患病个体的T细胞中表现为双等位表达。健康个体的T细胞中,野生型JAK1等位基因的表达比例达到75%以上,而患病个体的T细胞则显示出近乎等比例的双等位表达。这种表达模式的差异可能决定了突变等位基因的功能性信号增强是否足以触发相关疾病的表型,而患病个体中T细胞等比例的双等位基因表达使突变蛋白充分产生并跨越发病阈值。该结果表明,野生型和致病突变基因之间的等位基因失衡确实可以调节具有相同 gDNA 剂量的致病突变的个体的外显率。
③STAT1基因致病性变异病例
ⅠSTAT1基因功能缺失性变异:
常染色体显性STAT1基因功能缺失性变异(loss-of-function, LOF)是导致分枝杆菌病遗传易感性的已知原因;这是因为在II型干扰素 (IFNγ)通过IFNγR激活后,STAT1无法促进基因转录,且I型IFN反应受损将同时导致抗病毒免疫力的受损。
在一个带有STAT1 c.1976T>C (p.I659T)的家系中,有2名个体带有此突变,而只有先证者II-1患有严重的多发性结核病,I-1表型正常。为确定aRMAE是否是该病外显率不同的原因,研究人员通过ddPCR测定了所有白细胞亚型(包括CD3+T细胞、CD19+B细胞、CD56+NK细胞、经典单核细胞、中间单核细胞和非经典单核细胞)中野生型和突变STAT1等位基因的表达水平,发现健康个体的细胞均选择性表达野生型STAT1(AI=0.99-1.0),而患病个体的B细胞和单核细胞中表现为双等位表达。由此可推断,I-1个体中野生型等位基因的选择性表达可能是疾病不外显的原因。
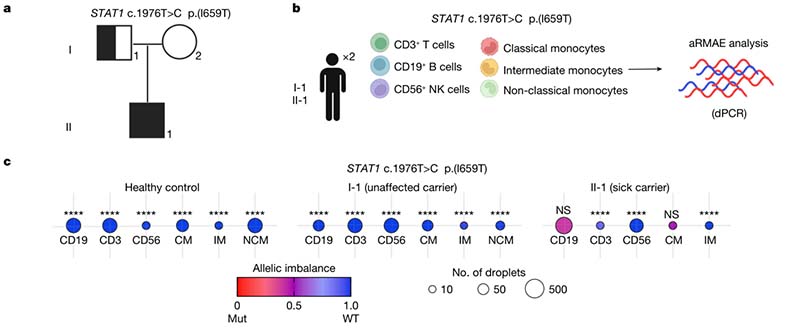
Ⅱ STAT1基因 GOF变异:
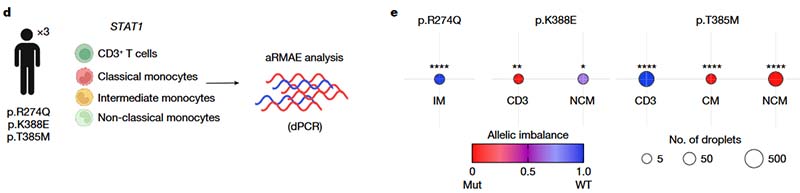
常染色体显性STAT1 GOF可导致STAT1蛋白过表达、磷酸化和转录活性的增强,均可能引起慢性粘膜皮肤念珠菌病(CMC)及相关免疫失调症的发生。CMC可能与循环中缺乏具有抗真菌免疫作用的可产生IL-17的T细胞有关。为确定 STAT1 aRMAE对常染色体显性STAT1 GOF病的影响,研究人员评估了3种STAT1基因GOF变异的表达:c.821G>A (p.R274Q)、c.1162A>G (p.K388E) 和 c.1154C>T (p.T385M),三者均为STAT1基因已知的致病性GOF变异。
从患者PBMC中分选CD3+T细胞和单核细胞,并通过ddPCR定量检测野生型及突变型STAT1的表达水平。P1、P2、P3的疾病表现度逐渐增高,实验发现P1(p.R274Q)中的细胞选择性表达野生型等位基因(AI=0.99),而P2(p.K388E)和P3(p.T385M)中的细胞表达两种等位基因或选择性表达突变等位基因。(P3中的CD3+T细胞则例外地选择性表达野生型等位基因(AI=0.99))
④CARD11基因 LOF变异病例
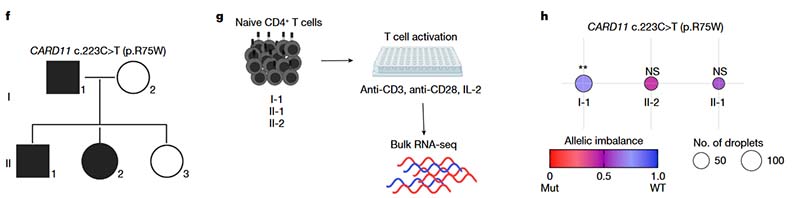
CARD11编码膜相关鸟苷酸激酶 (MAGUK) 蛋白家族,该家族蛋白在淋巴细胞激活过程中发挥重要作用,CARD11显性失活突变将影响T细胞活化和增殖以及初始T细胞分化。由于不存在异外显子SNP,CARD11 aRMAE无法在上述T细胞克隆中检测。
在一个携带CARD11 c.223C>T; p.(R75W)突变的家系中,3名携带者的疾病表现度(expressivity)不同。研究人员从他们的PBMC中分选幼稚CD4+T细胞,在IL-2存在的情况下用抗CD3和抗CD28进行T细胞活化,并利用bulk RNA-seq技术对每个CARD11等位基因进行分析。在表现度最高的II-2中,它偏向于突变型等位基因(AI=0.41),在表现度中等的II-1中,它略偏向于野生型等位基因(AI=0.58);而在表现度最低的I-1中,野生型等位基因(AI=0.72)则有显著的选择性表达。这一发现表明,在这个家族中,CARD11基因座的等位基因表达偏好与疾病表现度相关。
综上分析,对于携带PLCG2突变、JAK1 GOF突变及STAT1 LOF突变的个体,白细胞中野生型等位基因的选择性表达可确定疾病是否外显;而在携带STAT1 GOF突变与CARD11 LOF突变的个体中,突变等位基因的表达水平与疾病的表现度相关。
讨论及研究意义
在人类基因组中,大多数基因通过双等位基因表达(biallelic expression)实现稳定的遗传信息传递。然而,研究表明,约2%-10%的常染色体基因经历aRMAE,这种表达模式以随机性、稳定性和异质性为特点,曾被认为主要限于特殊基因家族(如嗅觉受体和免疫球蛋白基因)。本研究通过大规模基因组测序和表观遗传学分析首次证实,aRMAE广泛存在于IEI相关基因中,并对免疫调控基因表现出显著影响;这种随机表达直接影响了突变或野生型等位基因的表达比例,成为疾病外显率和表现度差异的决定性因素。
此外,研究还首次揭示了aRMAE与表观遗传修饰的紧密联系。通过抑制组蛋白去甲基酶(JMJD3)或DNA甲基转移酶(DNMT1),实验验证了表观遗传修饰(如H3K27me3和DNA甲基化)在调控aRMAE中的重要作用。这提示通过表观遗传学干预有望实现对突变基因表达的主动调控,从而缓解甚至逆转遗传病的严重表型。
在临床诊断中,aRMAE的检测能够补充传统的基因检测方法,为疾病不完全外显的患者提供更精准的疾病预测工具。本研究提示,相较于基因型(genotype)本身,展现基因表达情况的“转录型(transcriptotype)”可更准确地预测疾病的发生发展。通过结合基因组测序和RNA测序准确评估突变基因的表达模式,可为患者制定更具针对性的监测和治疗计划。
综上所述,本研究通过对aRMAE的机制、作用及其表型影响的系统探讨,为遗传病研究和精准医学开辟了新路径,为未来在分子水平上干预疾病提供了切实可行的理论框架。
